รีวิวมินิ
ด่านหน้าต้านมะเร็ง: เครื่องหมายมะเร็งสากลเท่านั้น
เฉิงเฉิน เฉียน1, เสี่ยวหลง ซู2, เว่ย ลี่1,3, หยินซาน ลี่4, เหวินเฉียง หยู5
1Shanghai Epiprobe Biotechnology Co., Ltd, เซี่ยงไฮ้ 200233, จีน;2 ภาควิชาศัลยศาสตร์ทั่วไป โรงพยาบาลในเครือแห่งแรกของ Harbin Medical University, Harbin 150001, จีน;3ซานตง Epiprobe Medical Laboratory Co., Ltd, Heze 274108, จีน;4 โรงพยาบาลประชาชนเขตปกครองตนเอง Ningxia Hui, มหาวิทยาลัยการแพทย์ Ningxia, Yinchuan 750002, จีน;5ศูนย์คลินิกสาธารณสุขเซี่ยงไฮ้ และภาควิชาศัลยศาสตร์ทั่วไป โรงพยาบาล Huashan และสถาบันการแพร่กระจายของมะเร็ง และห้องปฏิบัติการ RNA Epigenetics สถาบันวิทยาศาสตร์ชีวการแพทย์ วิทยาลัยการแพทย์เซี่ยงไฮ้ มหาวิทยาลัย Fudan เซี่ยงไฮ้ 200032 จีน
เชิงนามธรรม
มะเร็งเป็นสาเหตุการเสียชีวิตอันดับต้นๆ ทั่วโลกการตรวจพบมะเร็งตั้งแต่เนิ่นๆ สามารถลดอัตราการเสียชีวิตของมะเร็งทุกประเภทได้อย่างไรก็ตาม ตัวชี้วัดทางชีวภาพในการตรวจหามะเร็งตั้งแต่เนิ่นๆ ยังไม่เพียงพอสำหรับมะเร็งส่วนใหญ่DNA methylation เป็นเป้าหมายหลักที่น่าสนใจมาโดยตลอด เนื่องจาก DNA methylation มักเกิดขึ้นก่อนการเปลี่ยนแปลงทางพันธุกรรมอื่น ๆ ที่ตรวจพบได้ในขณะที่ตรวจสอบลักษณะทั่วไปของมะเร็งโดยใช้การจัดลำดับตำแหน่งใหม่สำหรับ DNA methylation ชุดของเครื่องหมายมะเร็งเท่านั้น (UCOM) ได้กลายเป็นตัวเลือกที่แข็งแกร่งสำหรับการตรวจหามะเร็งในระยะเริ่มแรกอย่างมีประสิทธิภาพและแม่นยำแม้ว่ามูลค่าทางคลินิกของตัวบ่งชี้ทางชีวภาพของมะเร็งในปัจจุบันจะลดลงเนื่องจากความไวต่ำและ/หรือความจำเพาะต่ำ แต่คุณลักษณะเฉพาะของ UCOM ช่วยให้มั่นใจได้ถึงผลลัพธ์ที่มีความหมายทางคลินิกการตรวจสอบศักยภาพทางคลินิกของ UCOM ในมะเร็งปอด มะเร็งปากมดลูก มะเร็งเยื่อบุโพรงมดลูก และมะเร็งท่อปัสสาวะ ยังสนับสนุนการใช้ UCOM ในมะเร็งหลายประเภทและสถานการณ์ทางคลินิกที่หลากหลายอีกด้วยในความเป็นจริง การใช้งานของ UCOM อยู่ระหว่างการตรวจสอบเชิงรุกพร้อมการประเมินเพิ่มเติมในการตรวจหามะเร็งในระยะเริ่มแรก การวินิจฉัยเสริม ประสิทธิภาพการรักษา และการติดตามการกลับเป็นซ้ำกลไกระดับโมเลกุลที่ UCOM ตรวจพบมะเร็งเป็นหัวข้อสำคัญต่อไปที่ต้องได้รับการตรวจสอบการประยุกต์ใช้ UCOM ในสถานการณ์จริงยังต้องมีการนำไปใช้และการปรับแต่งอีกด้วย
คำสำคัญ
การตรวจหามะเร็งการตรวจคัดกรองมะเร็งเมทิลเลชันของดีเอ็นเอเอพิเจเนติกส์ของมะเร็งไบโอมาร์คเกอร์มะเร็ง
เหตุใดเราจึงต้องการสิ่งใหม่อย่างเร่งด่วน ไบโอมาร์คเกอร์?
หลังจากต่อสู้กับโรคมะเร็งมานานกว่าศตวรรษ มะเร็งยังคงเป็นภัยคุกคามทางชีวภาพที่ร้ายแรงที่สุดต่อมนุษยชาติมะเร็งยังคงเป็นความกังวลด้านสุขภาพทั่วโลก โดยมีผู้ป่วยรายใหม่ 19.3 ล้านรายและผู้เสียชีวิตเกือบ 10 ล้านรายในปี 2563 ในปี 2563 มีการวินิจฉัยผู้ป่วยโรคมะเร็งรายใหม่ประมาณ 4.6 ล้านรายในประเทศจีน คิดเป็น 23.7% ของผู้ป่วยมะเร็งรายใหม่ทั่วโลกตามข้อมูลของ GLOBOCAN1นอกจากนี้ การเสียชีวิตประมาณ 3 ล้านคนมีสาเหตุมาจากโรคมะเร็งในประเทศจีนในปี 2563 ซึ่งคิดเป็น 30% ของการเสียชีวิตที่เกี่ยวข้องกับโรคมะเร็งทั่วโลก1สถิติเหล่านี้บ่งชี้ว่าจีนมีอัตราการเกิดและอัตราการเสียชีวิตด้วยโรคมะเร็งเป็นอันดับหนึ่งนอกจากนี้ อัตราการรอดชีวิตด้วยโรคมะเร็ง 5 ปีคือ 40.5% ซึ่งต่ำกว่าอัตราการรอดชีวิต 5 ปีในสหรัฐอเมริกา 1.5 เท่า2,3อัตราการรอดชีวิตและอัตราการเสียชีวิตที่สูงกว่าในประเทศจีนค่อนข้างต่ำกว่าในประเทศที่มีดัชนีการพัฒนามนุษย์สูงกว่า ชี้ให้เห็นว่าจำเป็นต้องมีระบบป้องกันและเฝ้าระวังมะเร็งที่มีประสิทธิภาพและคุ้มค่าอย่างเร่งด่วนการตรวจพบมะเร็งตั้งแต่เนิ่นๆ เป็นหนึ่งในองค์ประกอบที่สำคัญที่สุดในระบบการดูแลสุขภาพการตรวจพบมะเร็งในระยะเริ่มแรกสามารถปรับปรุงการพยากรณ์โรคและการอยู่รอดได้ในระยะเริ่มแรกในมะเร็งเกือบทุกประเภท4กลยุทธ์การตรวจคัดกรองที่ประสบความสำเร็จทำให้อุบัติการณ์และอัตราการเสียชีวิตของมะเร็งปากมดลูก มะเร็งเต้านม มะเร็งลำไส้ใหญ่ และมะเร็งต่อมลูกหมากลดลงอย่างมีนัยสำคัญ
อย่างไรก็ตาม การที่จะตรวจพบมะเร็งได้ตั้งแต่เนิ่นๆ นั้นไม่ใช่เรื่องง่ายการตรวจสอบชีววิทยาและการพยากรณ์โรคของมะเร็งในระยะเริ่มแรก การระบุและตรวจสอบความถูกต้องของตัวบ่งชี้ทางชีวภาพในการตรวจหามะเร็งในระยะเริ่มแรกที่เชื่อถือได้ และการพัฒนาเทคโนโลยีการตรวจจับตั้งแต่ระยะเริ่มต้นที่เข้าถึงได้และแม่นยำ ถือเป็นอุปสรรคใหญ่ที่สุดในกระบวนการนี้มาโดยตลอดการตรวจหามะเร็งที่แม่นยำสามารถแยกแยะเนื้องอกที่ไม่ร้ายแรงออกจากรอยโรคเนื้อร้ายได้ ซึ่งช่วยหลีกเลี่ยงขั้นตอนที่ไม่จำเป็น และอำนวยความสะดวกในการจัดการโรคต่อไปกลยุทธ์การตรวจหาในระยะเริ่มแรกในปัจจุบัน ได้แก่ การตัดชิ้นเนื้อโดยใช้กล้องเอนโดสโคป การถ่ายภาพทางการแพทย์ เซลล์วิทยา การตรวจอิมมูโนแอสเสย์ และการทดสอบตัวชี้วัดทางชีวภาพ5-7การตัดชิ้นเนื้อโดยใช้กล้องเอนโดสโคปถือเป็นการรบกวนและมีค่าใช้จ่ายสูง จึงมีภาระหนักมากเนื่องจากเป็นขั้นตอนทางการแพทย์ที่สำคัญที่ต้องอาศัยบุคลากรมืออาชีพเช่นเดียวกับเซลล์วิทยา วิธีการตรวจคัดกรองทั้งสองวิธีขึ้นอยู่กับผู้เชี่ยวชาญทางการแพทย์และขึ้นอยู่กับการตัดสินใจส่วนบุคคลด้วยประสิทธิภาพที่ยังห่างไกลจากอุดมคติ8ในทางตรงกันข้าม การตรวจอิมมูโนแอสเสย์มีความแม่นยำอย่างมาก เนื่องจากมีอัตราผลบวกลวงสูงการถ่ายภาพทางการแพทย์เป็นกลยุทธ์ในการคัดกรอง ต้องใช้อุปกรณ์ราคาแพงและช่างเทคนิคเฉพาะทางดังนั้น การถ่ายภาพทางการแพทย์จึงมีข้อจำกัดอย่างมาก เนื่องจากเข้าถึงได้น้อยด้วยเหตุผลทั้งหมดนี้ ตัวชี้วัดทางชีวภาพจึงดูเหมือนเป็นทางเลือกที่ดีกว่าสำหรับการตรวจหามะเร็งในระยะเริ่มแรก
จดหมายถึง: Yinshan Li และ Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
รหัส ORCID: https://orcid.org/0009-0005-3340-6802 และ
https://orcid.org/0000-0001-9920-1133
ได้รับเมื่อ 22 สิงหาคม 2023;ยอมรับในวันที่ 12 ตุลาคม 2023;
เผยแพร่ออนไลน์เมื่อวันที่ 28 พฤศจิกายน 2023
มีจำหน่ายที่ www.cancerbiomed.org
©2023 ชีววิทยามะเร็งและการแพทย์ครีเอทีฟคอมมอนส์
แสดงที่มา-ไม่ใช้เพื่อการค้า 4.0 ใบอนุญาตระหว่างประเทศ
ปัจจุบันตัวชี้วัดทางชีวภาพถูกจัดประเภทเป็นโปรตีน, เครื่องหมายการกลายพันธุ์ของ DNA, เครื่องหมาย epigenetic, ความผิดปกติของโครโมโซม, เครื่องหมาย RNA ที่ได้มาจากเนื้องอกโดยตรง หรือชิ้นส่วนของเนื้องอกที่ได้รับทางอ้อมจากของเหลวในร่างกายตัวบ่งชี้โปรตีนเป็นตัวบ่งชี้ทางชีวภาพที่ใช้กันอย่างแพร่หลายมากที่สุดในการคัดกรองและวินิจฉัยโรคมะเร็งตัวบ่งชี้ทางชีวภาพของโปรตีนในฐานะตัวบ่งชี้ทางชีวภาพในการคัดกรอง ถูกจำกัดโดยแนวโน้มที่จะได้รับผลกระทบจากรอยโรคที่ไม่ร้ายแรง ซึ่งนำไปสู่การวินิจฉัยมากเกินไปและการรักษามากเกินไป ดังที่มีการรายงานสำหรับ α-fetoprotein และแอนติเจนเฉพาะต่อมลูกหมาก (PSA)9,10เครื่องหมาย RNA รวมถึงรูปแบบการแสดงออกทางพันธุกรรมและเครื่องหมาย RNA อื่นๆ ที่ไม่เข้ารหัส การรวมกันของเครื่องหมาย RNA การแสดงออกทางพันธุกรรมสามารถตรวจพบได้โดยใช้ตัวอย่างปัสสาวะ ซึ่งความไวของเนื้องอกปฐมภูมิยังห่างไกลจากที่น่าพอใจ (60%) และการตรวจหาซึ่งสามารถ ได้รับผลกระทบจากลักษณะการย่อยสลายง่ายของ RNA ในสภาพแวดล้อมปกติเครื่องหมายทางพันธุกรรมและอีพิเจเนติกส์ต่างเผชิญกับปัญหาความชุกของเนื้องอกและข้อจำกัดของชนิดของมะเร็ง
DNA methylation เป็นตัวเลือกที่แข็งแกร่งในฐานะตัวบ่งชี้ทางชีวภาพในการตรวจหาตั้งแต่เนิ่นๆ นับตั้งแต่ Feinberg เชื่อมโยงกับมะเร็งครั้งแรกในปี 198312 ความผิดปกติของ DNA methylation นั้นพบได้ในทุกระยะของมะเร็งตั้งแต่ระยะแรกเริ่มของมะเร็งDNA hypermethylation ที่ผิดปกติมักเกิดขึ้นบนเกาะ CpG ในโปรโมเตอร์ยีนเพื่อต่อต้านตัวยับยั้งเนื้องอกการศึกษายังชี้ให้เห็นว่า DNA hypermethylation ที่ผิดปกตินั้นมีส่วนร่วมในการควบคุมหน่วยงานกำกับดูแลการพัฒนาDNA methylation Valley ซึ่งมักเกี่ยวข้องกับตัวควบคุมพัฒนาการและมะเร็งที่มีเมทิลเลตสูง อาจเปลี่ยนโหมดการแสดงออกของยีนไปเป็นโหมดที่ขึ้นกับ DNA methylation ที่เสถียรกว่า และลดการเชื่อมต่อกับ methylated histone H3K27me3 และโปรตีน polycomb ที่เกี่ยวข้อง
ในบรรดาเครื่องหมาย DNA methylation ที่ตีพิมพ์จำนวนมาก มีหลายแห่งที่ประสบความสำเร็จในการออกสู่ตลาดอย่างไรก็ตาม เครื่องหมาย DNA methylation ที่จำหน่ายในเชิงพาณิชย์ในปัจจุบันและแผงวินิจฉัยยังไม่สามารถปลดล็อกศักยภาพในการตรวจหามะเร็งในระยะเริ่มแรกได้อย่างสมบูรณ์ด้วยเหตุผลหลายประการในขณะที่ส่วนใหญ่แสดงประสิทธิภาพที่ยอมรับได้โดยใช้ข้อมูลฐานข้อมูล ตัวชี้วัดทางชีวภาพเหล่านี้มักจะทำงานได้ดีในอุดมคติน้อยกว่าในโลกแห่งความเป็นจริง เนื่องจากข้อเท็จจริงที่ว่าตัวอย่างในโลกแห่งความเป็นจริงมักจะซับซ้อนกว่าและไม่ได้เป็นตัวแทนเหมือนกับตัวอย่างที่เลือกในฐานข้อมูลการตรวจหาเมทิลเลชั่นมะเร็งหลายชนิดในระยะเริ่มแรกนั้นแสดงให้เห็นว่ามีความไวเพียง 16.8% และ 40.4% ในมะเร็งระยะที่ 1 และ 2 ตามลำดับการทดสอบการตรวจจับตั้งแต่เนิ่นๆ จำเป็นต้องมีความเสถียรมากขึ้นและไบโอมาร์คเกอร์ที่แม่นยำยิ่งขึ้น
การค้นพบเครื่องหมายมะเร็งสากลเท่านั้น (UCOM) โดยใช้ลำดับตำแหน่งแนะนำ (GPS)
แม้จะมีการวิจัยโรคมะเร็งมานานหลายทศวรรษ แต่การป้องกันและการรักษาที่น่าพอใจยังไม่เกิดขึ้นจำเป็นต้องมีวิธีการใหม่เพื่อให้นักวิจัยประเมินมะเร็งได้อย่างละเอียดในช่วง 23 ปีที่ผ่านมา จุดเด่นของมะเร็ง 6 ประการ เช่น การหลีกเลี่ยงการตายของเซลล์ การบุกรุกของเนื้อเยื่อ และการแพร่กระจายของเนื้อร้าย ฯลฯ ได้รับการขยายเป็น 14 ประการโดยการรวมคุณลักษณะต่างๆ เช่น การเขียนโปรแกรมซ้ำทางพันธุกรรมแบบ nonmutational และ microbiomes แบบโพลีมอร์ฟิกเมื่อมีการเปิดเผยรายละเอียดเพิ่มเติมเกี่ยวกับโรคมะเร็ง จึงมีการนำเสนอมุมมองเพิ่มเติมในการวิจัยโรคมะเร็งการวิจัยโรคมะเร็งได้ค่อยๆ เข้าสู่ยุคใหม่ใน 2 ทิศทาง (ความเหมือนกันและความเป็นปัจเจกบุคคล)ด้วยการพัฒนาด้านเนื้องอกวิทยาที่มีความแม่นยำในช่วงไม่กี่ปีที่ผ่านมา จุดเน้นของการวิจัยโรคมะเร็งจึงมุ่งเน้นไปที่การรักษาแบบกำหนดเป้าหมายเป็นรายบุคคลและความหลากหลายของมะเร็งดังนั้นตัวบ่งชี้ทางชีวภาพของมะเร็งที่ระบุเมื่อเร็ว ๆ นี้จึงมุ่งเน้นไปที่มะเร็งประเภทเฉพาะเป็นหลัก เช่น PAX6 มะเร็งปากมดลูก และ BMP3 สำหรับมะเร็งลำไส้ใหญ่และทวารหนักประสิทธิภาพของตัวบ่งชี้ทางชีวภาพเหล่านี้ที่จำเพาะต่อประเภทของมะเร็งนั้นแตกต่างกันไป แต่ก็ยังเป็นไปไม่ได้ที่บุคคลที่อ่อนแอจะได้รับการตรวจคัดกรองมะเร็งทั้งหมดพร้อมกัน เนื่องจากข้อจำกัดในการได้มาซึ่งตัวอย่างทางชีวภาพและค่าใช้จ่ายสูงคงจะดีไม่น้อยหากเราสามารถระบุตัวบ่งชี้ทางชีวภาพที่มีประสิทธิภาพเพียงตัวเดียวซึ่งมีประสิทธิภาพสำหรับมะเร็งทุกประเภทในระยะเริ่มต้น
เพื่อให้บรรลุเป้าหมายในอุดมคติดังกล่าว จะต้องเลือกตัวเลือกตัวบ่งชี้ทางชีวภาพที่ดีกว่าจากรายการประเภทตัวบ่งชี้ทางชีวภาพที่เป็นไปได้ความผิดปกติของ DNA methylation ในทุกโปรไฟล์ทางพันธุกรรมและ epigenetic เป็นที่ทราบกันว่าเกี่ยวข้องกับมะเร็ง และเป็นหนึ่งในความผิดปกติที่เก่าแก่ที่สุด (ไม่ใช่อย่างแรก) ที่เกี่ยวข้องกับมะเร็งที่จะเกิดขึ้นตามลำดับเวลาการตรวจสอบ DNA methylation เริ่มต้นตั้งแต่เนิ่นๆ แต่ถูกขัดขวางเนื่องจากขาดวิธีการวิจัยในบรรดาตำแหน่งที่เป็นไปได้ของ CpG ที่มีเมทิลเลตจำนวน 28 ล้านตำแหน่งในจีโนมนั้น จะต้องตรวจพบจำนวนที่สามารถจัดการได้และสอดคล้องกับจีโนมเพื่อให้เข้าใจการเกิดเนื้องอกได้ดียิ่งขึ้นการจัดลำดับไบซัลไฟต์ทั้งจีโนม (WGBS) ซึ่งถือเป็นมาตรฐานทองคำของการจัดลำดับดีเอ็นเอเมทิลเลชั่น สามารถครอบคลุม Cs ในเซลล์มะเร็งได้เพียง 50% เท่านั้น เนื่องจากธรรมชาติของการบำบัดด้วยไบซัลไฟต์ที่จะทำลายชิ้นส่วน DNA และลดความซับซ้อนของจีโนมระหว่าง การเปลี่ยนแปลงของ Cs-to-Ts25วิธีการอื่นๆ เช่น ชิป 450,000 ครอบคลุมเพียง 1.6% ของเมทิลเลชั่นของจีโนมเท่านั้นจากข้อมูล 450,000 แผงการตรวจจับ DNA methylation มีความไว 35.4% สำหรับมะเร็งระยะที่ 1 6 ประเภทข้อจำกัดของประเภทของมะเร็ง ประสิทธิภาพที่ไม่ดี และเสียงที่เกิดจากวิธีการตรวจจับในกระบวนการวิเคราะห์ กลายเป็นอุปสรรคที่ยิ่งใหญ่ที่สุดสำหรับแผงการตรวจจับมะเร็งในกระทะ
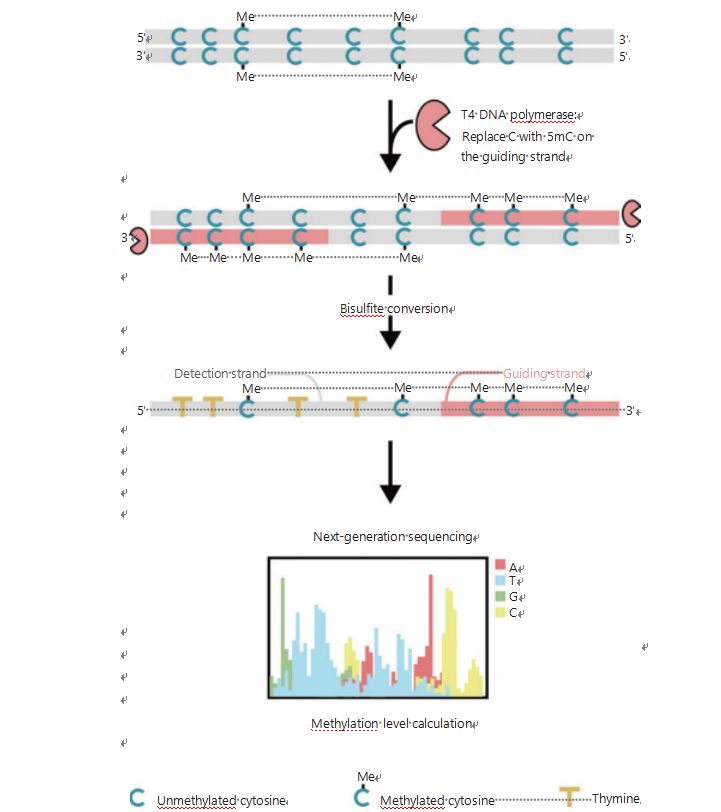
เพื่อตรวจสอบรูปแบบอีพิเจเนติกส์ของเซลล์ได้ดีขึ้นในระหว่างการเกิดเนื้องอกและการแพร่กระจาย เราได้พัฒนา GPS ที่เป็นเอกลักษณ์สำหรับการตรวจจับ DNA methylation ทั่วทั้งจีโนม ซึ่งครอบคลุมมากถึง 96% ของไซต์ CpG ในการอ่าน 0.4 พันล้านครั้งGPS เป็นวิธีการหาลำดับทวิภาคีโดยใช้ส่วนปลาย 3′ ของชิ้นส่วน DNA ของเมทิล-ไซโตซีนที่ไม่สามารถแปลงสภาพได้หลังการบำบัดด้วยไบซัลไฟต์ ซึ่งเป็นแนวทางในการจัดตำแหน่งการคำนวณ DNA methylation ของปลาย 5′ ผ่านการเรียงลำดับปลายคู่ (รูปที่ 1)แนวทางเมทิลไซโตซีนซึ่งทำหน้าที่เป็นแม่แบบเทมเพลตช่วยในการจัดตำแหน่งภูมิภาค GC สูงที่กู้คืนข้อมูลลำดับที่ถูกละทิ้งมากที่สุดใน WGBS แบบดั้งเดิมคุณสมบัติการครอบคลุมสูงของ GPS ให้ข้อมูล DNA methylation จำนวนมหาศาล ซึ่งช่วยให้เราสามารถตรวจสอบโปรไฟล์ methylation ของมะเร็งด้วยความละเอียดสูงกว่ามากในภูมิภาคที่อยู่ภายใต้การตรวจสอบก่อนหน้านี้
GPS ให้เครื่องมืออันทรงพลังแก่เราในการตรวจสอบความเป็นเนื้อเดียวกันของมะเร็ง ซึ่งสามารถลดความซับซ้อนของการวิจัยโรคมะเร็งอย่างมาก และอาจค้นหาคำอธิบายที่เป็นสากลสำหรับการเกิดเนื้องอกและการแพร่กระจายของเนื้อร้ายขณะวิเคราะห์ข้อมูล GPS ของเซลล์มะเร็ง มักพบปรากฏการณ์พิเศษอย่างหนึ่งมีหลายภูมิภาคที่ดูเหมือนจะมีไฮเปอร์เมทิลเลตอย่างผิดปกติในตัวอย่างมะเร็งหลายประเภทการค้นพบที่ไม่คาดคิดนี้ได้รับการตรวจสอบในภายหลังเพื่อใช้เป็น UCOMมีการวิเคราะห์ตัวอย่างมากกว่า 7,000 ตัวอย่างจากมะเร็ง 17 ชนิดในฐานข้อมูล Cancer Genome Atlas (TCGA) ซึ่งในนั้นเราได้ระบุ UCOM ตัวแรก HIST1H4F ซึ่งเป็นยีนที่เกี่ยวข้องกับฮิสโตนซึ่งมีไฮเปอร์เมทิลเลตในมะเร็งทุกประเภทจากนั้นจึงพบชุด UCOM และตรวจสอบความถูกต้องในฐานข้อมูล TCGA ฐานข้อมูล Gene Expression Omnibus (GEO) และตัวอย่างทางคลินิกในโลกแห่งความเป็นจริงณ ขณะนี้ HIST1H4F, PCDHGB7 และ SIX6 ถูกค้นพบและตรวจสอบว่าเป็น UCOM แล้วการค้นพบ UCOM โดยไม่คาดคิดถือเป็นคำตอบที่มีประสิทธิภาพสำหรับความจำเป็นในการตรวจหามะเร็งในระยะเริ่มแรกUCOM นำเสนอโซลูชั่นสำหรับการตรวจหามะเร็งหลายชนิดด้วยเครื่องหมายเดียว
ลักษณะของ UCOM
เมื่อตรวจสอบความถูกต้องแล้ว UCOM ได้แสดงให้เห็นว่ามีลักษณะสำคัญสี่ประการที่ทำให้ UCOM สามารถเกินประสิทธิภาพของตัวบ่งชี้ทางชีวภาพในปัจจุบันได้ (รูปที่ 2)
เป็นเอกลักษณ์เฉพาะของความร้ายกาจ
UCOM มีลักษณะเฉพาะกับรอยโรคที่เป็นมะเร็งหรือก่อนเป็นมะเร็ง และไม่ได้รับผลกระทบจากการเปลี่ยนแปลงทางสรีรวิทยาตามปกติเครื่องหมายที่เกี่ยวข้องกับมะเร็งในปัจจุบันบางส่วนที่มีการนำไปใช้อย่างกว้างขวางในการตรวจหาและ/หรือการตรวจคัดกรองตั้งแต่เนิ่นๆ ได้นำไปสู่การวินิจฉัยมากเกินไประดับ PSA ที่สูงขึ้นซึ่งเป็นเครื่องมือคัดกรองที่ได้รับการรับรองทางการแพทย์ จะถูกตรวจพบในสภาวะที่ไม่เป็นอันตราย เช่น ต่อมลูกหมากโตและต่อมลูกหมากอักเสบการวินิจฉัยมากเกินไปและการรักษามากเกินไปส่งผลให้คุณภาพชีวิตลดลงเนื่องจากภาวะแทรกซ้อนทางลำไส้ ทางเดินปัสสาวะ และทางเพศ28ตัวชี้วัดทางชีวภาพที่ใช้โปรตีนอื่นๆ และใช้กันอย่างแพร่หลายในสถานพยาบาล เช่น CA-125 ไม่ได้ให้ประโยชน์อย่างมีนัยสำคัญในขณะที่เกิดการวินิจฉัยเกินและการรักษามากเกินไป29ความจำเพาะสูงของ UCOM สำหรับมะเร็งช่วยหลีกเลี่ยงข้อบกพร่องเหล่านี้UCOM, PCDHGB7 สามารถแยกแยะรอยโรค squamous intraepithelial (HSILs) และมะเร็งปากมดลูกคุณภาพสูงจากตัวอย่างปกติและรอยโรค squamous intraepithelial (LSILs) เกรดต่ำได้อย่างมีประสิทธิภาพ ในขณะที่ตัวบ่งชี้ทางชีวภาพอื่นๆ ส่วนใหญ่สามารถแยกแยะมะเร็งปากมดลูกจากตัวอย่างปกติเท่านั้นแม้ว่า PCDHGB7 จะไม่ตรวจพบความแตกต่างที่มีนัยสำคัญระหว่างเยื่อบุโพรงมดลูกปกติและภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ (endometrium) แต่ความแตกต่างที่มีนัยสำคัญจะถูกตรวจพบระหว่างเยื่อบุโพรงมดลูกปกติและภาวะเจริญเกินผิดปกติ และตรวจพบความแตกต่างที่มากยิ่งขึ้นระหว่างเยื่อบุโพรงมดลูกปกติและมะเร็งเยื่อบุโพรงมดลูก (EC) โดยยึดตาม PCDHGB731UCOM มีลักษณะเฉพาะสำหรับรอยโรคเนื้อร้ายในฐานข้อมูลและตัวอย่างทางคลินิกจากมุมมองของผู้ป่วย UCOM ที่เป็นเอกลักษณ์จะช่วยลดเกณฑ์ในการทำความเข้าใจข้อบ่งชี้ที่ซับซ้อนของตัวบ่งชี้ทางชีวภาพที่ไม่เสถียรต่างๆ ที่มีประสิทธิภาพต่ำ และความวิตกกังวลที่เกี่ยวข้องในระหว่างกระบวนการประเมินจากมุมมองของแพทย์ UCOM ที่เป็นเอกลักษณ์เฉพาะจะแยกแยะมะเร็งออกจากรอยโรคที่ไม่ร้ายแรง ซึ่งช่วยในการคัดแยกผู้ป่วยและลดขั้นตอนทางการแพทย์ที่ไม่จำเป็นและการรักษามากเกินไปดังนั้น UCOM ที่เป็นเอกลักษณ์จะช่วยลดความซ้ำซ้อนของระบบการแพทย์ บรรเทาความทุกข์ของระบบ และจัดหาทรัพยากรทางการแพทย์เพิ่มเติมให้กับผู้ที่ต้องการ
รูปที่ 1 แผนผังขั้นตอนการทำงานของ GPS สำหรับการตรวจจับ DNA methylation25เส้นสีเทา: ลำดับ DNA อินพุต;เส้นสีแดง: DNA ที่ได้รับการรักษาด้วย T4 DNA polymerase แทนที่ cytosine ด้วย 5′-methylcytosine ที่ปลาย 3′ ของอินพุต;สีน้ำเงิน C กับฉัน: methylated cytosine;สีน้ำเงิน C: ไซโตซีนที่ไม่ได้รับเมทิลเลต;T สีเหลือง: thymine25.
ทั้งหมดหรือไม่มีอะไร
UCOM มีอยู่ในเซลล์มะเร็งเท่านั้นและตรวจพบได้อย่างเสถียรในเซลล์มะเร็งเกือบทั้งหมดHIST1H4F ได้รับการตรวจสอบว่ามีไฮเปอร์เมทิลเลตในเนื้องอกเกือบทุกประเภท แต่ไม่ใช่ในตัวอย่างที่ปกติ 27ในทำนองเดียวกัน PCDHGB7 และ SIX6 ก็แสดงให้เห็นว่ามีไฮเปอร์เมทิลเลตในตัวอย่างเนื้องอกทั้งหมด แต่ไม่ใช่ในตัวอย่างปกติคุณลักษณะเฉพาะนี้ปรับปรุงประสิทธิภาพของ UCOM อย่างมีนัยสำคัญโดยคำนึงถึงขีดจำกัดของการตรวจจับและความไวเซลล์มะเร็งสามารถแยกแยะความแตกต่างได้เพียง 2% ในตัวอย่าง ทำให้ UCOM กลายเป็นไบโอมาร์คเกอร์ที่ละเอียดอ่อนมากกว่าไบโอมาร์คเกอร์ที่มีอยู่ส่วนใหญ่30 ในฐานะไบโอมาร์คเกอร์ที่ใช้สำหรับการตรวจหามะเร็งลำไส้ใหญ่และทวารหนัก การกลายพันธุ์ของ KRAS มีอยู่เฉพาะในประมาณ 36% ของผู้ป่วยมะเร็งลำไส้ใหญ่และทวารหนักเท่านั้น บ่งชี้ถึงศักยภาพในการวินิจฉัยที่ไม่ดี 33ความชุกที่ต่ำของการกลายพันธุ์ของ KRAS ในมะเร็งลำไส้ใหญ่และทวารหนักจะจำกัด KRAS เมื่อใช้ร่วมกับตัวบ่งชี้ทางชีวภาพอื่นๆในความเป็นจริง การรวมกันของตัวบ่งชี้ทางชีวภาพอาจดูมีแนวโน้มในช่วงแรก แต่ก็ไม่ได้ให้ผลลัพธ์ที่น่าพอใจเสมอไป ในขณะที่แสดงให้เห็นสัญญาณรบกวนมากขึ้นในการวิเคราะห์การตรวจจับ และมักจะเกี่ยวข้องกับขั้นตอนการทดลองที่ซับซ้อนมากขึ้นในทางตรงกันข้าม PCDHGB7 และ UCOM อื่น ๆ มีอยู่ในมะเร็งทั้งหมดUCOM ตรวจจับส่วนประกอบของมะเร็งในตัวอย่างมะเร็งประเภทต่างๆ ด้วยความแม่นยำสูงสุด ขณะเดียวกันก็ขจัดกระบวนการวิเคราะห์การตัดเสียงรบกวนที่ซับซ้อนการตรวจหามะเร็งในกลุ่มตัวอย่างที่มีจำนวนมากไม่ใช่เรื่องยาก แต่การตรวจหามะเร็งในกลุ่มตัวอย่างเล็กๆ ถือเป็นเรื่องท้าทายอย่างยิ่งUCOM สามารถตรวจจับมะเร็งได้ในปริมาณเล็กน้อย
รูปที่ 2 ลักษณะของ UCOM
การตรวจหามะเร็งก่อนการเปลี่ยนแปลงทางพยาธิวิทยา
UCOM สามารถตรวจพบได้ในระยะก่อนเกิดมะเร็งก่อนการเปลี่ยนแปลงทางพยาธิวิทยาในฐานะตัวบ่งชี้ทางชีวภาพของ epigenetic ความผิดปกติของ UCOM เกิดขึ้นในระยะเร็วกว่าความผิดปกติของฟีโนไทป์ และสามารถตรวจพบได้ตลอดทั้งการสร้างเนื้องอก การลุกลาม และการแพร่กระจายความไวของ UCOM เมื่อเวลาผ่านไปช่วยเพิ่มประสิทธิภาพ UCOM ในการตรวจหามะเร็งระยะเริ่มแรกและรอยโรคก่อนเกิดมะเร็งการตรวจหามะเร็งในระยะเริ่มแรกโดยอาศัยการตัดชิ้นเนื้อและเซลล์วิทยาอาจเป็นเรื่องยากสำหรับนักพยาธิวิทยาที่มีประสบการณ์มากที่สุดการตรวจชิ้นเนื้อครั้งเดียวที่ได้รับผ่านทางคอลโปสโคปได้รับการรายงานว่าเป็นบวกใน 60.6% ของตัวอย่าง HSIL+จำเป็นต้องมีการตรวจชิ้นเนื้อเพิ่มเติมสำหรับรอยโรคหลาย ๆ เพื่อเพิ่มความไว 36ในทางตรงกันข้าม UCOM หรือ PCDHGB7 มีความไว 82% สำหรับตัวอย่าง HSIL+ ซึ่งเหนือกว่าความไวของการตัดชิ้นเนื้อและตัวบ่งชี้ทางชีวภาพส่วนใหญ่เครื่องหมายเมทิลเลชัน FAM19A4 มีความไว 69% สำหรับ CIN2+ ซึ่งคล้ายกับเซลล์วิทยา แต่ไม่สามารถแยกความแตกต่างของ CIN1 จากตัวอย่างปกติUCOM ได้รับการแสดงให้เห็นว่าเป็นตัวบ่งชี้ทางชีวภาพในการตรวจหาตั้งแต่เนิ่นๆ ที่ละเอียดอ่อนกว่ามากเมื่อเปรียบเทียบกับนักพยาธิวิทยาตามประสบการณ์ UCOM มีความไวในการตรวจจับที่เหนือกว่าสำหรับมะเร็งระยะเริ่มแรก ซึ่งในทางกลับกันมีส่วนช่วยในการพยากรณ์โรคมะเร็งและการอยู่รอดที่ดีขึ้นนอกจากนี้ UCOM ยังมีแพลตฟอร์มการตรวจจับที่สามารถเข้าถึงได้ในพื้นที่ที่ขาดนักพยาธิวิทยาที่มีประสบการณ์ และช่วยปรับปรุงประสิทธิภาพการตรวจจับอย่างมากด้วยขั้นตอนการสุ่มตัวอย่างและการตรวจจับที่สม่ำเสมอ การตรวจจับ UCOM จะให้ผลลัพธ์ที่เสถียรและง่ายต่อการตีความ ซึ่งเหมาะสมกับโปรโตคอลการตรวจคัดกรองที่ต้องใช้บุคลากรมืออาชีพและทรัพยากรทางการแพทย์น้อยลง
ง่ายต่อการตรวจจับ
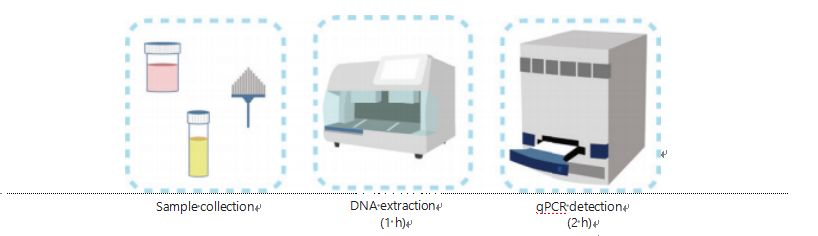
วิธีการตรวจหา DNA methylation ในปัจจุบันมีความซับซ้อนและใช้เวลานานวิธีการส่วนใหญ่จำเป็นต้องมีการเปลี่ยนรูปไบซัลไฟต์ ซึ่งทำให้คุณภาพของตัวอย่างลดลง และอาจให้ผลลัพธ์ที่ไม่เสถียรและไม่ถูกต้องความสามารถในการทำซ้ำได้ต่ำซึ่งเกิดจากการบำบัดไบซัลไฟต์อาจทำให้เกิดความสับสนสำหรับแพทย์และผู้ป่วย และยังรบกวนกลยุทธ์การติดตามผลและ/หรือการรักษาอีกด้วยดังนั้นเราจึงปรับเปลี่ยนวิธีการตรวจจับ UCOM เพิ่มเติมเพื่อหลีกเลี่ยงการบำบัดไบซัลไฟต์ที่เป็นปัญหาสำหรับตัวอย่าง รองรับข้อกำหนดการใช้งานทางคลินิก และเพิ่มความสามารถในการเข้าถึงเราได้พัฒนาวิธีการใหม่โดยใช้เอนไซม์จำกัดความไวต่อเมทิลเลชั่นรวมกับ PCR เชิงปริมาณฟลูออเรสเซนต์แบบเรียลไทม์ (Me-qPCR) เพื่อหาปริมาณสถานะเมทิลเลชั่นของ UCOM ภายใน 3 ชั่วโมงโดยใช้ขั้นตอนการจัดการที่ง่าย (รูปที่ 3)Me-qPCR สามารถรองรับตัวอย่างได้หลายประเภท เช่น การเก็บตัวอย่างของเหลวในร่างกายทางคลินิก และตัวอย่างปัสสาวะที่เก็บด้วยตนเองตัวอย่างทางคลินิกที่รวบรวมมาสามารถดำเนินการ จัดเก็บ และดำเนินการตรวจจับได้อย่างง่ายดายโดยใช้การสกัด DNA ที่เป็นมาตรฐานและอัตโนมัติDNA ที่สกัดออกมาสามารถนำไปใช้กับแพลตฟอร์ม Me-qPCR ได้โดยตรงสำหรับปฏิกิริยาแบบหม้อเดียวและผลลัพธ์ปริมาณผลลัพธ์หลังจากการวิเคราะห์ผลลัพธ์อย่างง่ายโดยใช้แบบจำลองการวินิจฉัยที่ติดตั้งและตรวจสอบความถูกต้องของมะเร็งชนิดใดชนิดหนึ่งแล้ว การพิจารณาขั้นสุดท้ายของผลลัพธ์การตรวจจับ UCOM จะถูกตีความและนำเสนอเป็นค่ากึ่งปริมาณแพลตฟอร์ม Me-qPCR มีประสิทธิภาพเหนือกว่าไบซัลไฟต์-ไพโรซีเควนซ์แบบดั้งเดิมในการตรวจจับ UCOM ในขณะที่ประหยัดเวลาในการแปลงไบซัลไฟต์ได้ 3 ชั่วโมง ตามโปรโตคอลชุด EZ DNA Methylation-Goldแพลตฟอร์มการตรวจจับเมทิลเลชั่นที่เป็นนวัตกรรมใหม่ทำให้การตรวจจับ UCOM มีเสถียรภาพมากขึ้น แม่นยำยิ่งขึ้น และเข้าถึงได้มากขึ้น30
รูปที่ 3 กระบวนการตรวจจับ UCOMประเภทตัวอย่าง ได้แก่ BALF ที่สุ่มตัวอย่างอย่างมืออาชีพ แปรงตรวจ Pap และ/หรือปัสสาวะที่เก็บเองกระบวนการสกัด DNA สามารถใช้งานร่วมกับเครื่องสกัดอัตโนมัติ ซึ่งสามารถตรวจจับผลิตภัณฑ์ได้โดยตรงด้วย qPCR
การประยุกต์ใช้ UCOM
โรคมะเร็งปอด
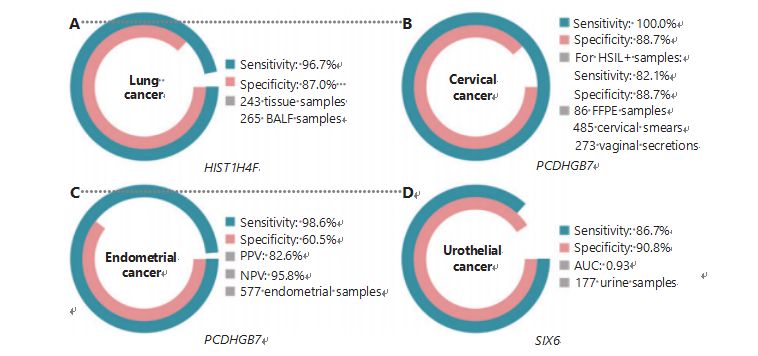
มะเร็งปอดเป็นมะเร็งที่ได้รับการวินิจฉัยบ่อยที่สุดเป็นอันดับสองและเป็นอันตรายถึงชีวิตมากที่สุดในโลก โดยคิดเป็นร้อยละ 11.4 ของผู้ป่วยรายใหม่ และ 18.0% ของการเสียชีวิตรายใหม่1ในบรรดาการวินิจฉัยทั้งหมด 85% เป็นมะเร็งปอดชนิดไม่ใช่เซลล์ขนาดเล็ก (NSCLC) และ 15% เป็นมะเร็งปอดชนิดเซลล์ขนาดเล็ก (SCLC) ซึ่งมีระดับความร้ายแรงที่สูงกว่า38การสแกนด้วยเอกซเรย์คอมพิวเตอร์ขนาดต่ำ (LDCT) เป็นวิธีการตรวจคัดกรองมะเร็งปอดที่แนะนำในปัจจุบัน และแสดงให้เห็นว่าสามารถปรับปรุงการตรวจพบตั้งแต่เนิ่นๆ และลดอัตราการเสียชีวิต6อย่างไรก็ตาม เนื่องจากความจำเพาะต่ำและการเข้าถึงได้ไม่ดี LDCT จึงยังไม่สามารถใช้เป็นวิธีการคัดกรองที่น่าพอใจ เช่นเดียวกับเครื่องหมายมะเร็งอื่น ๆ ทั่วไป เช่น CEA39ค่าใช้จ่ายและศักยภาพในการวินิจฉัยที่พลาดและการวินิจฉัยผิดพลาดของกลยุทธ์การตรวจคัดกรอง LDCT ขัดขวางความก้าวหน้าของการส่งเสริมการตรวจคัดกรองมะเร็งปอดHIST1H4F ซึ่งเป็น UCOM มีศักยภาพมหาศาลในการตรวจหาตัวบ่งชี้ทางชีวภาพตั้งแต่เนิ่นๆ ในตัวอย่างของเหลวในหลอดลม (BALF)HIST1H4F มีไฮเปอร์เมทิลเลตในมะเร็งของต่อมในปอดและมะเร็งเซลล์สความัสในปอด โดยมีความจำเพาะในการตรวจจับ 96.7% และความไว 87.0% (รูปที่ 4A) และประสิทธิภาพที่ยอดเยี่ยมสำหรับมะเร็งระยะที่ 1HIST1H4F มีความจำเพาะ 96.5% และความไว 85.4% สำหรับ NSCLC และ 96.5% และ 95.7% ตามลำดับสำหรับ SCLC27นอกจากนี้ ตัวอย่างมะเร็งอีก 8 ชนิด รวมถึงมะเร็งตับอ่อนและมะเร็งลำไส้ใหญ่ ได้ตรวจสอบแล้วว่า HIST1H4F มีไฮเปอร์เมทิลเลตในทั้ง 8 ชนิด
มะเร็งปากมดลูก
มะเร็งปากมดลูกเป็นมะเร็งที่ได้รับการวินิจฉัยบ่อยที่สุดเป็นอันดับสี่ และเป็นสาเหตุอันดับที่สี่ของการเสียชีวิตด้วยโรคมะเร็งในผู้หญิงในปี 2563 คิดเป็น 3.1% ของผู้ป่วยรายใหม่ และ 3.4% ของการเสียชีวิตที่เกี่ยวข้องกับโรคมะเร็งทั่วโลก1ตามที่องค์การอนามัยโลกเสนอ เพื่อกำจัดมะเร็งปากมดลูกภายในปี 2573 การตรวจหามะเร็งปากมดลูกตั้งแต่เนิ่นๆ จึงมีความจำเป็นหากตรวจพบตั้งแต่ระยะแรก อัตราการรอดชีวิต 5 ปีจะสูงถึง 92% ด้วยมะเร็งปากมดลูกที่ลุกลาม41แนวทางของสมาคมโรคมะเร็งแห่งอเมริกา (ACS) เสนอแนะการทดสอบเซลล์วิทยาของปากมดลูก การทดสอบ HPV เบื้องต้น หรือการทดสอบร่วมเพื่อการตรวจคัดกรอง42เซลล์วิทยาของปากมดลูกแพร่กระจายและสามารถตรวจพบได้เพียง 63.5% ของกรณี CIN2+37
ในทางตรงกันข้าม PCDHGB7 ทำงานได้ดีกว่ามากโดยใช้การตรวจแปปสเมียร์และสารคัดหลั่งในช่องคลอด และสามารถแยกแยะ HSIL จาก LSIL ได้อย่างมีประสิทธิภาพในระยะเริ่มแรกPCDHGB7 เพียงอย่างเดียวมีความไว 100.0% และความจำเพาะ 88.7% สำหรับมะเร็งปากมดลูก (รูปที่ 4B) และความไว 82.1% และความจำเพาะ 88.7% สำหรับตัวอย่าง HSIL +PCDHGB7 ยังมีความไว 90.9% และความจำเพาะ 90.4% ในตัวอย่างสารคัดหลั่งในช่องคลอดสำหรับมะเร็งปากมดลูก ซึ่งเก็บได้ง่ายกว่ามาก30เมื่อรวมกับการทดสอบ HPV ที่มีความเสี่ยงสูง (ชม.) หรือการทดสอบ Thinprep Cytology Test (TCT) PCDHGB7 มีความไวเพิ่มขึ้น 95.7% และความจำเพาะ 96.2% ซึ่งเหนือกว่าการทดสอบ hrHPV อย่างมีนัยสำคัญ (20.3%), TCT (51.2%) ) และทั้งสองอย่างรวมกัน (57.8%) สำหรับมะเร็งปากมดลูก30PCDHGB7 ยังแสดงให้เห็นว่ามีไฮเปอร์เมทิลเลตในมะเร็ง 17 ชนิดจากฐานข้อมูล TCGA ซึ่งบ่งบอกถึงความเหมาะสมในตระกูล UCOM
รูปที่ 4 UCOM ได้รับการตรวจสอบความถูกต้องในมะเร็งสี่ประเภทในการศึกษาทางคลินิกขนาดใหญ่A. ประสิทธิภาพของ HIST1H4F ซึ่งเป็น UCOM ในการตรวจหามะเร็งปอดจำนวน 508 ตัวอย่างข. ประสิทธิภาพของ PCDHGB7 ซึ่งเป็น UCOM ในการตรวจหามะเร็งปากมดลูกจำนวน 844 ตัวอย่างC. ประสิทธิภาพของ PCDHGB7 ซึ่งเป็น UCOM ในการตรวจหามะเร็งเยื่อบุโพรงมดลูกของตัวอย่างแปรง Pap และ Tao ในเยื่อบุโพรงมดลูก 577 ตัวอย่างD. ประสิทธิภาพของ SIX6 ซึ่งเป็น UCOM ในการตรวจหามะเร็งท่อปัสสาวะจำนวน 177 ตัวอย่าง
EC
EC เป็นหนึ่งในมะเร็งระบบสืบพันธุ์เพศหญิงที่พบบ่อยที่สุดทั่วโลก โดยมีผู้ป่วยรายใหม่ประมาณ 4.2 ล้านรายและ 1% ของการเสียชีวิตจากโรคมะเร็งทุกปี1ด้วยการวินิจฉัยที่ประสบความสำเร็จในระยะเริ่มต้น EC สามารถรักษาได้และมีอัตราการรอดชีวิต 5 ปีที่ 95% สำหรับมะเร็งระยะที่ 1ผู้ป่วยที่มีอาการ เช่น เลือดออกผิดปกติในมดลูก จะได้รับการประเมินทางคลินิกเป็นระยะๆ และได้รับการตรวจชิ้นเนื้อที่ลุกลามและเจ็บปวด แม้ว่าในที่สุดจะพัฒนา EC43 เพียง 5%–10% ก็ตามอัลตราซาวนด์ทางช่องคลอดเป็นวิธีการตรวจจับทั่วไปนั้นไม่น่าเชื่อถืออย่างมาก เนื่องจากไม่สามารถแยกแยะความเป็นพิษเป็นภัยจากการเปลี่ยนแปลงของเยื่อบุโพรงมดลูกที่เป็นมะเร็งได้และมีอัตราผลบวกลวงสูง
ทำการเปรียบเทียบแบบขนานของซีรั่ม CA-125 ซึ่งเป็นตัวชี้วัดทางชีวภาพของ EC ที่ใช้กันอย่างแพร่หลาย และ PCDHGB7ซีรั่ม CA-125 มีความไว 24.8% ซึ่งแสดงให้เห็นว่า CA-125 เป็นเครื่องหมายที่ไม่เพียงพอสำหรับ EC แม้ว่าจะมีความจำเพาะ 92.3%31การตรวจจับ PCDHGB7 โดยใช้ตัวอย่าง Pap Brush ให้ความไว 80.65% และความจำเพาะ 82.81% สำหรับระยะ ECatall ในขณะที่แปรง Tao มีความไว 61.29% และความจำเพาะ 95.31%แบบจำลองการวินิจฉัย PCDHGB7 ซึ่งใช้ Me-qPCR ให้ผลลัพธ์ความไว 98.61% ความจำเพาะ 60.5% และความแม่นยำโดยรวม 85.5% โดยใช้ตัวอย่างแปรง Pap และ Tao (รูปที่ 4C)
มะเร็งท่อปัสสาวะ
มะเร็งท่อปัสสาวะ ซึ่งประกอบด้วยมะเร็งกระเพาะปัสสาวะ กระดูกเชิงกรานของไต และมะเร็งท่อไต เป็นมะเร็งที่ได้รับการวินิจฉัยบ่อยที่สุดเป็นอันดับ 7 ของโลกในปี 2563 ส่งผลให้มีผู้ป่วยรายใหม่ 5.2% และเสียชีวิต 3.9%มะเร็งท่อปัสสาวะ ซึ่งมากกว่า 50% เป็นมะเร็งกระเพาะปัสสาวะ เป็นมะเร็งที่ได้รับการวินิจฉัยบ่อยที่สุดเป็นอันดับสี่ในสหรัฐอเมริกาในปี 2565 คิดเป็น 11.6% ของผู้ป่วยที่เพิ่งได้รับการวินิจฉัย3ประมาณ 75% ของมะเร็งกระเพาะปัสสาวะจัดเป็นมะเร็งกระเพาะปัสสาวะที่ไม่รุกรานกล้ามเนื้อ ซึ่งจำกัดอยู่ที่เยื่อเมือกหรือใต้เยื่อเมือกการตรวจชิ้นเนื้อในกระเพาะปัสสาวะเป็นมาตรฐานทองคำสำหรับการวินิจฉัยมะเร็งท่อปัสสาวะที่ดำเนินการโดยการเรืองแสงในแหล่งกำเนิด (FISH) และการทดสอบทางเซลล์วิทยาปลาและเซลล์วิทยามีประสิทธิภาพในการวินิจฉัยไม่ดี และการตรวจซิสโตสโคปรบกวนและมีความเสี่ยงที่ซ่อนอยู่ในการเกิดรอยโรคขนาดเล็ก การตีความรอยโรคผิด และอาจก่อให้เกิดการแพร่กระจายหรือการกำเริบของมะเร็ง46UCOM ที่ได้รับการตรวจสอบก่อนหน้านี้ PCDHGB7 ก็แสดงให้เห็นว่ามีไฮเปอร์เมทิลเลตในมะเร็งท่อปัสสาวะ โดยมีพื้นที่ใต้เส้นโค้ง 0.86 ซึ่งบ่งบอกถึงความสามารถในการวินิจฉัยที่เป็นไปได้เพื่อตรวจสอบ UCOM ได้มากขึ้นและรองรับประเภทตัวอย่างได้มากขึ้น SIX6 ซึ่งเป็น UCOM ใหม่ ได้รับการตรวจสอบและแสดงให้เห็นศักยภาพในการวินิจฉัยที่ดีเยี่ยมในการตรวจหามะเร็งท่อปัสสาวะในระยะเริ่มแรก โดยใช้ตัวอย่างปัสสาวะบนแพลตฟอร์ม Me-qPCRการตรวจจับ SIX6 โดยใช้ตัวอย่างปัสสาวะแสดงให้เห็นถึงความไวในการแข่งขันที่ 86.7% และความจำเพาะที่ 90.8% (รูปที่ 4D) ในขณะที่ไม่รุกรานและง่ายต่อการได้มาศักยภาพของ SIX6 ในการติดตามการแพร่กระจายและการประเมินประสิทธิภาพการรักษาอยู่ระหว่างการตรวจสอบ
อนาคตและความท้าทาย
UCOM มีประสิทธิภาพที่แข็งแกร่งในศักยภาพในการวินิจฉัยโรคมะเร็งหลายชนิด แต่ยังมีงานที่ต้องทำอีกมากเราได้ขยายรายชื่อ UCOM และทำการตรวจสอบความถูกต้องของ UCOM ในมะเร็งประเภทต่างๆ มากขึ้น รวมถึงมะเร็งที่ปกติแล้วจะตรวจพบได้ยากผลการตรวจสอบความถูกต้องจากฐานข้อมูล TCGA ได้ยืนยันการใช้งาน UCOM ในมะเร็งหลายประเภทและสถานการณ์มากขึ้นในการตรวจสอบเบื้องต้น UCOM แสดงให้เห็นว่ามีศักยภาพในการวินิจฉัยมะเร็งท่อน้ำดีและมะเร็งตับอ่อนได้อย่างแข็งแกร่ง ซึ่งแทบจะเป็นไปไม่ได้เลยที่จะวินิจฉัยในระยะเริ่มต้นด้วยวิธีคัดกรองในปัจจุบันความสามารถในการตรวจหามะเร็งที่หายากด้วย UCOM สามารถนำไปใช้กับ DNA ของเนื้องอกที่หมุนเวียน (ctDNA) โดยแพลตฟอร์มการตรวจชิ้นเนื้อของเหลวที่ได้รับการปรับปรุงการศึกษาที่เกี่ยวข้องกับแผงตรวจหามะเร็งตับที่ใช้พลาสมา DNA ให้ผลความไว 57.9%49แม้จะมีความจำเพาะสูง แต่ประสิทธิภาพโดยรวมยังเผยให้เห็นว่ายังมีสิ่งที่ต้องปรับปรุงอีก
ลักษณะเฉพาะของ UCOM ยังสนับสนุนการตรวจสอบศักยภาพของ UCOM ในการประเมินประสิทธิภาพการรักษาและการติดตามการเกิดซ้ำตามเกณฑ์การประเมินการตอบสนองในเนื้องอกที่เป็นของแข็ง (RECIST) การถ่ายภาพทางการแพทย์เป็นวิธีที่แนะนำสำหรับการติดตามการเกิดซ้ำและการประเมินประสิทธิภาพการรักษา ในขณะที่ตัวบ่งชี้มะเร็งจะใช้เพียงอย่างเดียวในการประเมิน 50อย่างไรก็ตาม ในความเป็นจริง วิธีการถ่ายภาพได้รับผลกระทบอย่างมากจากความถี่และจังหวะเวลา และทำให้ผู้ป่วยมีความเสี่ยงและค่าใช้จ่ายสูงขึ้นSIX6 ได้รับการตรวจสอบแล้วว่าทำหน้าที่เป็นตัวทำนายการแพร่กระจายของมะเร็งเต้านมการตรวจติดตาม ctDNA ที่ใช้การตรวจชิ้นเนื้อของเหลวช่วยให้สามารถเฝ้าระวังแบบเรียลไทม์สำหรับโรคที่ตกค้างน้อยที่สุดหลายเดือนก่อนการตรวจจับด้วยรังสีวิทยา ซึ่งจะช่วยชะลอและป้องกันการลุกลามของมะเร็งที่เกี่ยวข้องกับการกำเริบของโรคผลลัพธ์เบื้องต้นชี้ให้เห็นว่า UCOM สะท้อนถึงระดับของไฮเปอร์เมทิลเลชั่นที่เป็นมะเร็งแบบเรียลไทม์ทันทีหลังการผ่าตัดและการรักษาความไวสูงที่แสดงโดย UCOM และการบังคับใช้ในตัวอย่างหลายประเภทที่ไม่ก้าวก่ายทำให้ UCOM สามารถทำหน้าที่เป็นตัวบ่งชี้ทางชีวภาพในการตรวจสอบการเกิดซ้ำที่แม่นยำ ขณะเดียวกันก็รักษาการปฏิบัติตามข้อกำหนดของผู้ป่วยในระดับสูง
ในขณะเดียวกัน การเข้าถึงแบบทดสอบของสาธารณะก็เป็นอีกประเด็นสำคัญที่ต้องใช้ความพยายามเพิ่มเติมแม้ว่าความร่วมมือในการตรวจจับของ UCOM จะถูกนำมาใช้ในโรงพยาบาลหลายแห่งโดยหวังว่าจะเป็นประโยชน์ต่อผู้ป่วยมากขึ้น แต่การตรวจจับและคัดกรอง pro bono ก็มีการดำเนินการอย่างแข็งขันในชนบทของจีนUCOM ต้องการการเข้าถึงที่ได้รับการปรับปรุงเพื่อให้มีคุณสมบัติเป็นเครื่องมือคัดกรองที่เป็นไปได้ โดยเฉพาะอย่างยิ่งสำหรับพื้นที่ด้อยพัฒนา
แม้ว่าผลลัพธ์ของแอปพลิเคชัน UCOM ในการตรวจจับตั้งแต่เนิ่นๆ จะมีแนวโน้มดี แต่ก็ยังมีสิ่งที่เราไม่ทราบมากมายเกี่ยวกับ UCOM อยู่ด้วยการสำรวจเชิงรุก การวิจัยเพิ่มเติมจึงรับประกันได้ว่าเหตุใด UCOM จึงปรากฏอยู่ในมะเร็งในระดับสากลกลไกการควบคุม epigenetic ที่เป็นรากฐานของ UCOM นั้นสมควรได้รับการตรวจสอบเพิ่มเติม ซึ่งอาจพิสูจน์ทิศทางใหม่สำหรับการรักษาโรคมะเร็งเมื่อกลับไปสู่การทำงานร่วมกันระหว่างความเป็นเนื้อเดียวกันของเนื้องอกและความแตกต่าง เราสนใจว่าทำไม UCOM จึงเป็นข้อยกเว้นสำหรับตัวบ่งชี้ทางชีวภาพของมะเร็งส่วนใหญ่ที่เชื่อมโยงอย่างแน่นหนากับมะเร็งบางชนิดบทบาทของความผิดปกติของ DNA methylation ที่ระบุโดย UCOM ในการสร้างเนื้องอก การลุกลามของเนื้องอก และการแพร่กระจายของเนื้อร้ายยังไม่ได้รับการพิจารณาในกระบวนการสูญเสียและฟื้นเอกลักษณ์ของเซลล์ และจำเป็นต้องมีการตรวจสอบอย่างละเอียดความสนใจที่สำคัญอีกประการหนึ่งอยู่ที่ขอบเขตของการรวมลักษณะความเป็นเนื้อเดียวกันของ UCOM เข้ากับเครื่องหมายเฉพาะของเนื้อเยื่อ โดยหวังว่าจะเข้าใกล้การตรวจหาร่องรอยมะเร็งอย่างแม่นยำ และการระบุต้นกำเนิดของเนื้อเยื่อเนื้องอกในลักษณะย้อนกลับUCOM สามารถเป็นเครื่องมือในอุดมคติในการป้องกันมะเร็ง ตรวจจับมะเร็ง และอาจป้องกันและกำจัดมะเร็งได้
ให้การสนับสนุน
งานนี้ได้รับการสนับสนุนจากโครงการวิจัยและพัฒนาแห่งชาติของจีน (Grant No. 2022BEG01003), มูลนิธิวิทยาศาสตร์ธรรมชาติแห่งชาติของจีน (Grant No. 32270645 และ 32000505), Grant จากคณะกรรมการสุขภาพประจำจังหวัดเฮยหลงเจียง (Grant No. 2020-111) และทุนสนับสนุนจากสถาบันวิทยาศาสตร์และเทคโนโลยีเหอเจ๋อ (ทุนหมายเลข 2021KJPT07)
คำชี้แจงความขัดแย้งทางผลประโยชน์
Wei Li เป็นผู้อำนวยการฝ่ายวิจัยและพัฒนาของบริษัท Shanghai Epiprobe Biotechnology Co., Ltd. ส่วน Wenqiang Yu ดำรงตำแหน่งในคณะกรรมการที่ปรึกษาด้านวิทยาศาสตร์ของ EpiprobeW. Yu และ Epiprobe ได้อนุมัติสิทธิบัตรที่รอดำเนินการที่เกี่ยวข้องกับงานนี้ผู้เขียนคนอื่นๆ ทั้งหมดประกาศว่าไม่มีผลประโยชน์ในการแข่งขัน
ผลงานของผู้เขียน
คิดและออกแบบโครงการ: Chengchen Qian และ Wenqiang Yu
เขียนบทความ: เฉิงเฉินเฉียน
ทำภาพประกอบ: Chengchen Qian
ตรวจทานและเรียบเรียงต้นฉบับ: เสี่ยวหลง โซว, เว่ย ลี, หยินชาน ลี และเหวินเฉียง หยู
อ้างอิง
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A และคณะสถิติมะเร็งทั่วโลก 2020: การประมาณการของ GLOBOCAN
อุบัติการณ์และการเสียชีวิตทั่วโลกสำหรับโรคมะเร็ง 36 รายใน 185 ประเทศซีเอ แคนเซอร์ เจ คลินิก2021;71:209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S และอื่นๆสถิติโรคมะเร็งในประเทศจีนและสหรัฐอเมริกา ปี 2022: โปรไฟล์ แนวโน้ม และปัจจัยกำหนดชินเมดเจ (อังกฤษ)2022;135: 584-90.
3. ซีเกล อาร์แอล, มิลเลอร์ KD, WagleNS, เจมาลาเอสถิติมะเร็งปี 2566 CA Cancer J Clin2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, และคณะการตรวจพบมะเร็งในระยะเริ่มแรกศาสตร์.2022;375:eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.กลยุทธ์สำหรับ
การตรวจคัดกรองมะเร็งลำไส้ใหญ่ระบบทางเดินอาหาร.2020;158: 418-32.
6. ทานูเอ แอลที, แทนเนอร์ เอ็นที, โกลด์ เอ็มเค, ซิลเวสตรี จีเอการตรวจคัดกรองมะเร็งปอดAm J Respir Crit Care Med2558;191:19-33.
7. บูวาร์ด วี, เวนเซนเซนเอ็น, แม็กกี้ เอ, เบิร์กฮอฟ เจ, บราเดอร์ตันเจ, จอร์จี-รอสซี พี และคณะมุมมองของ IARC ต่อการตรวจคัดกรองมะเร็งปากมดลูกN EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoYความท้าทายของโคลโปสโคปสำหรับการตรวจคัดกรองมะเร็งปากมดลูกใน LMIC และวิธีแก้ปัญหาด้วยปัญญาประดิษฐ์บีเอ็มซี เมด.2020;18:169.
9. จอห์นสัน พี, โจว คิว, Dao DY, Lo YMDการหมุนเวียนตัวชี้วัดทางชีวภาพในการวินิจฉัยและการจัดการมะเร็งตับNat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Serum การตรวจหามะเร็งต่อมลูกหมากในระยะเริ่มแรกโดยใช้ PSA ในยุโรปและทั่วโลก: อดีต ปัจจุบัน และอนาคตแนท เรฟ อูโรล2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
และคณะการพัฒนาการทดสอบปัสสาวะ Multiplex RNA สำหรับการตรวจหาและการแบ่งชั้นของมะเร็งเซลล์เปลี่ยนผ่านของกระเพาะปัสสาวะคลินิกมะเร็ง Res.2551;14: 742-9.
12. Feinberg AP, Vogelstein B. Hypomethylation แยกยีนของมะเร็งในมนุษย์ออกจากยีนปกติธรรมชาติ.1983;301:89-92.
13. Ng JM, Yu J. ส่งเสริมไฮเปอร์เมทิลเลชั่นของยีนต้านเนื้องอกในฐานะไบโอมาร์คเกอร์ที่มีศักยภาพในมะเร็งลำไส้ใหญ่IntJ โมลวิทย์2558;16: 2472-96.
14. Esteller M. Cancer epigenomics: DNA methylomes และแผนที่การปรับเปลี่ยนฮิสโตนแนท เรฟ เจเน็ท.2550;8: 286-98.
15. Nishiyama A, Nakanishi M. การสำรวจภูมิทัศน์ DNA methylation ของมะเร็งเทรนด์เจเน็ต2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P, และคณะการวิเคราะห์ทางอีพิจีโนมิกของการสร้างความแตกต่างหลายสายเลือดของเซลล์ต้นกำเนิดจากตัวอ่อนมนุษย์เซลล์2556;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X และคณะการวิเคราะห์ทั่วทั้งจีโนมเผยให้เห็นบทบาทของ Polycomb ในการส่งเสริมไฮโปเมทิลเลชั่นของ DNA methylation Valleyจีโนมไบโอล2561;19:18.
18. คอช เอ, จูสเทนเอสซี, เฟิง แซด, เดอ รุยเตอร์ ทีซี, ดราห์ทเอ็มเอ็กซ์, เมล็อตเต้วี,
และคณะการวิเคราะห์ DNA methylation ในมะเร็ง: มาเยือนอีกครั้งแนท เรอคลิน อ้นคอล.2561;15:459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, และคณะการตรวจสอบทางคลินิกของการทดสอบการตรวจหามะเร็งหลายชนิดในระยะเริ่มแรกโดยใช้เมทิลเลชั่นเป้าหมายโดยใช้ชุดการตรวจสอบอิสระแอน ออนคอล.2021;32: 1167-77.
20. ฮานาฮัน ดี, ไวน์เบิร์ก RA.จุดเด่นของโรคมะเร็งเซลล์2000;100: 57-70.
21. ฮานาฮัน ดี. จุดเด่นของโรคมะเร็ง: มิติใหม่มะเร็งดิสคอฟ2022;12:31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. เนื้องอกวิทยาที่แม่นยำ: ใคร อย่างไร อะไร เมื่อใด และเมื่อใดไม่?หนังสือ Am Soc Clin Oncol Educ2017:160-9.
23. Liu H, Meng X, Wang J. เมทิลเลชั่นเชิงปริมาณแบบเรียลไทม์
การตรวจหายีน PAX1 ในการตรวจคัดกรองมะเร็งปากมดลูกมะเร็งนรีเวช IntJ2020;30:1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, และคณะการทดสอบ DNA แบบหลายเป้าหมายสำหรับการตรวจคัดกรองมะเร็งลำไส้ใหญ่และทวารหนักN EnglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S, และคณะการวางตำแหน่งไกด์
การจัดลำดับระบุรูปแบบ DNA methylation ที่ผิดปกติซึ่งเปลี่ยนแปลงเอกลักษณ์ของเซลล์และเครือข่ายการเฝ้าระวังภูมิคุ้มกันของเนื้องอกจีโนม
ความละเอียด2019;29:270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY และคณะการตรวจหามะเร็งหลายชนิดที่ไม่รบกวนโดยการหมุนเวียน DNA methylation sequencing (THUNDER) แบบไร้เซลล์: การพัฒนาและการศึกษาการตรวจสอบความถูกต้องโดยอิสระแอน ออนคอล.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, และคณะยีนที่เกี่ยวข้องกับฮิสโตนนั้นมีไฮเปอร์เมทิลเลตในมะเร็งปอดและไฮเปอร์เมทิลเลต
HIST1H4F สามารถทำหน้าที่เป็นตัวบ่งชี้ทางชีวภาพของมะเร็งตับได้มะเร็ง Res2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, และคณะผลกระทบคุณภาพชีวิตของการตรวจคัดกรองแอนติเจนเฉพาะต่อมลูกหมากN EnglJ Med.2555;367: 595-605.
29 LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. ประสิทธิภาพทางคลินิกของการทดสอบ biomarker คัดกรองมะเร็งที่นำเสนอเป็นบริการด้านสุขภาพแบบชำระเงินด้วยตนเอง: การทบทวนอย่างเป็นระบบยูโรเจ สาธารณสุข.2559;26: 498-505.
30. Dong S, Lu Q,Xu P, Chen L, Duan X, Mao Z และอื่นๆ
Hypermethylated PCDHGB7 เป็นเครื่องหมายบ่งชี้มะเร็งสากลเท่านั้น และการนำไปใช้ในการตรวจคัดกรองมะเร็งปากมดลูกในระยะเริ่มแรกคลินิกแปล Med.2021;11: e457.
31. หยวน เจ เหมา ซี หลู คิว ซู พี วัง ซี ซู X และคณะHypermethylated PCDHGB7 เป็นตัวชี้วัดทางชีวภาพสำหรับการตรวจหามะเร็งเยื่อบุโพรงมดลูกในระยะเริ่มต้นในตัวอย่างแปรงเยื่อบุโพรงมดลูกและเศษปากมดลูกด้านหน้า โมล บิโอสซี2022;8: 774215.
32. ตง เอส หยาง ซี ซู พี เจิ้ง ดับบลิว จาง บี ฟู เอฟ และคณะซึ่งกันและกัน
การดัดแปลง epigenetic แบบเอกสิทธิ์เฉพาะบุคคลใน SIX6 พร้อมไฮเปอร์เมทิลเลชั่นสำหรับระยะมะเร็งและการติดตามการแพร่กระจายของเนื้อร้ายเป้าหมายการถ่ายโอนสัญญาณ Ther.2022;7: 208.
33. Huang L, Guo Z,Wang F, Fu L. KRAS การกลายพันธุ์: จากที่ไม่สามารถใช้ยาไปจนถึงสามารถวางยาได้ในมะเร็งเป้าหมายการถ่ายโอนสัญญาณ Ther.2021;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE และคณะเมทิลเลชั่นที่ผิดปกติของ p16 (INK4a) เป็นเหตุการณ์ที่เกิดขึ้นในมะเร็งปอดและตัวชี้วัดทางชีวภาพที่มีศักยภาพสำหรับการวินิจฉัยโรคในระยะเริ่มแรกProc Natl Acad Sci สหรัฐอเมริกา1998;95: 11891-6.
35. โรเบิร์ตสัน เคดี.DNA methylation และโรคของมนุษย์แนท เรฟ เจเน็ท.2548;6: 597-610.
36. เวนเซนเซ่น, วอล์คเกอร์ เจแอล, โกลด์ เอ็มเอ, สมิธ KM, ซูนาเร,
แมทธิวส์ ซี และคณะการตัดชิ้นเนื้อหลายครั้งและการตรวจหาสารตั้งต้นของมะเร็งปากมดลูกที่โคลโปสโคปเจ คลิน อ้นคอล.2558;33:83-9.
37. เดอ สทรูปเปอร์ แอลเอ็ม, ไมเยอร์ ซีเจ, เบิร์กฮอฟ เจ, เฮสส์ลิงค์ เอที, สไนจ์เดอร์ส
PJ, Steenbergen RD และคณะการวิเคราะห์เมทิเลชันของ FAM19A4
ยีนในรอยถลอกของปากมดลูกมีประสิทธิภาพสูงในการตรวจจับปากมดลูก
มะเร็งและรอยโรค CIN2/3 ขั้นสูงมะเร็งก่อนหน้า Res (Phila)2014;7: 1251-7.
38. ไทยเอเอ, โซโลมอน BJ, Sequist LV, Gainor JF, Heist RSโรคมะเร็งปอด.มีดหมอ2021;398: 535-54.
39. กรันเน็ต เอ็ม, โซเรนเซ่น เจบี.Carcinoembryonic antigen (CEA) เป็นเครื่องหมายมะเร็งในมะเร็งปอดโรคมะเร็งปอด.2555;76: 138-43.
40. ไม้ DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, และคณะการคัดกรองมะเร็งปอด เวอร์ชัน 3.2018 แนวทางปฏิบัติทางคลินิกของ NCCN ด้านเนื้องอกวิทยาJ Natl Compr Canc Netw.2561;16: 412-41.
41. สมาคมมะเร็งอเมริกันข้อเท็จจริงและตัวเลขเกี่ยวกับโรคมะเร็งแอตแลนตา จอร์เจีย สหรัฐอเมริกา: สมาคมมะเร็งอเมริกัน;2023 [อัปเดต 2023 วันที่ 1 มีนาคม;อ้างถึง 2023 22 สิงหาคม]
42. FonthamETH, Wolf AMD, โบสถ์ TR, EtzioniR, ดอกไม้ CR,
เฮอร์ซิก เอ และคณะการตรวจคัดกรองมะเร็งปากมดลูกสำหรับบุคคลที่มีความเสี่ยงโดยเฉลี่ย: อัปเดตแนวปฏิบัติปี 2020 จาก American Cancer Societyซีเอ แคนเซอร์ เจ คลินิก2020;70: 321-46.
43 Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. สมาคมความเสี่ยงมะเร็งเยื่อบุโพรงมดลูกที่มีเลือดออกในวัยหมดประจำเดือนในสตรี: การทบทวนอย่างเป็นระบบและการวิเคราะห์เมตาดาต้าJAMA แพทย์ฝึกหัด2561;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
ชาร์มา เอ และคณะความไวของการตรวจคัดกรองอัลตราซาวนด์ทางช่องคลอด
สำหรับมะเร็งเยื่อบุโพรงมดลูกในสตรีวัยหมดประจำเดือน: การศึกษาแบบมีกลุ่มควบคุมภายในกลุ่ม UKCTOCSมีดหมอ Oncol2554;12:38-48.
45. BabjukM, เบอร์เกอร์ M, CompératEM, Gontero P, MostafidAH,
ปาลูเจ และคณะแนวทางของสมาคมระบบทางเดินปัสสาวะแห่งยุโรปเกี่ยวกับมะเร็งกระเพาะปัสสาวะแบบไม่รุกรานกล้ามเนื้อ (TaT1 และมะเร็งในแหล่งกำเนิด) -
อัปเดตปี 2019ยูโร อูโรล.2019;76: 639-57.
46. เจบี อารากอน-ชิงความท้าทายและความก้าวหน้าในการวินิจฉัย ชีววิทยา และการรักษามะเร็งทางเดินปัสสาวะส่วนบนและมะเร็งกระเพาะปัสสาวะอูรอล ออนคอล.2560;35: 462-4.
47. ริซวี เอส, คันซา, ฮาลเลไมเออร์ ซีแอล, เคลลีย์ RK, กอร์ส จีเจ
มะเร็งท่อน้ำดี – แนวคิดและแนวทางการรักษาที่ก้าวหน้าแนท เรอคลิน อ้นคอล.2561;15:95-111.
48. Ye Q, Ling S, Zheng S, Xu X. การตรวจชิ้นเนื้อของเหลวในเซลล์ตับ
มะเร็ง: การหมุนเวียนเซลล์เนื้องอกและการหมุนเวียน DNA ของเนื้องอกโมลมะเร็ง2019;18:114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K และคณะมะเร็งตับ
การหมุนเวียนการตรวจจับ DNA ของเนื้องอกในผู้ป่วยชาวจีนกว่า 10,000 รายแนทคอม.2021;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R, และคณะเกณฑ์การประเมินการตอบสนองใหม่ในเนื้องอกที่เป็นของแข็ง: แนวทาง RECIST ที่แก้ไขแล้ว (เวอร์ชัน 1.1)ยูโร เจ แคนเซอร์.2552;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - เรียนรู้จากอดีตเพื่อสร้างอนาคตแนท เรอคลิน อ้นคอล.
2560;14:187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S, และคณะiRECIST: แนวทางเกณฑ์การตอบสนองเพื่อใช้ในการทดลอง
การทดสอบภูมิคุ้มกันบำบัดมีดหมอ Oncol2560;18: e143-52.
53. PantelK, Alix-Panabières C. การตรวจชิ้นเนื้อของเหลวและโรคตกค้างน้อยที่สุด - ความก้าวหน้าล่าสุดและผลกระทบต่อการรักษาแนท เรอคลิน อ้นคอล.2019;16:409-24.
อ้างอิงบทความนี้เป็น: Qian C, Zou X, Li W, Li Y, Yu W. ด่านหน้าต่อต้านมะเร็ง: เครื่องหมายมะเร็งสากลเท่านั้นยารักษาโรคมะเร็ง2023;20: 806-815.
ดอย: 10.20892/j.issn.2095-3941.2023.0313
เวลาโพสต์: May-07-2024